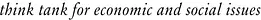Avant de pouvoir commercialiser un médicament, les entreprises pharmaceutiques doivent déposer une demande d’autorisation de mise sur le marché auprès de l’autorité d’autorisation compétente. En Suisse, les autorisations sont délivrées par Swissmedic, et dans l’Union européenne par l’Agence européenne des médicaments (EMA). Représentant un marché beaucoup plus important, l’UE reçoit généralement ces demandes avant la Suisse, et bénéficie ainsi plus rapidement des nouveaux médicaments. Cette inégalité risque de s’accroitre à l’avenir et ce sont les patients suisses qui en subiront les conséquences.
Une concurrence internationale rude
Si la Suisse est considérée comme le pays des géants pharmaceutiques, cela ne veut pas dire qu’elle dispose des nouveaux médicaments avant les autres. Au contraire, afin que la Suisse puisse bénéficier de nouveaux médicaments, cette dernière doit patienter davantage que l’Europe ou les Etats-Unis. La plupart du temps, les entreprises pharmaceutiques déposent d’abord une demande d’autorisation auprès de la Food and Drug Administration (FDA), l’autorité d’autorisation américaine. Avec 330 millions d’habitants, les Etats-Unis constituent un marché principal mondial. Peu après, les demandes sont déposées auprès de l’EMA (UE), et ce n’est que bien plus tard qu’elles sont déposées auprès de Swissmedic (voir figure 1). Entre 2012 et 2016, la Suisse a dû patienter en moyenne 84 jours de plus que les Etats-Unis et 71 jours de plus que l’UE. Depuis, la situation s’est détériorée et ces écarts se sont accrus : entre 2017 et 2021, la Suisse devait attendre en moyenne 138 jours de plus que les Etats-Unis (+64%), et 118 jours de plus que l’UE (+66%).
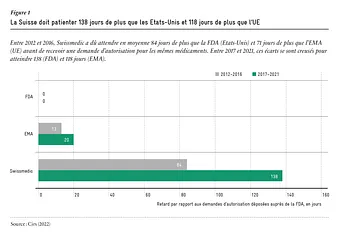
Le moment du dépôt de la demande d’autorisation n’est pas le seul facteur qui compte. La durée nécessaire pour délivrer une autorisation est également essentielle. Ici, l’EMA est généralement plus rapide que Swissmedic. Entre 2015 et 2021, l’EMA mettait en moyenne 424 jours pour délivrer son autorisation, tandis que l’Institut suisse en nécessitait 472. Cependant, Swissmedic s’efforce de raccourcir ce délai et cela semble avoir porté ses fruits : en 2021, pour la première fois, Swissmedic a été plus rapide que son homologue européen (voir figure 2).
Un retard qui risque de s’accentuer
Mais la concurrence entre Swissmedic et l’EMA pourrait se renforcer. La Commission européenne a proposé le 26 avril dernier une révision de la législation pharmaceutique de l’UE. Avec les nouvelles dispositions, l’EMA disposera de 180 jours (contre 210 actuellement) pour évaluer un nouveau médicament, soit 30 jours de moins qu’aujourd’hui. Pour l’évaluation des médicaments présentant un intérêt majeur pour la santé publique, l’EMA disposera d’un délai encore plus court de 150 jours seulement. Cette proposition de réforme devra encore être examinée par le Parlement et le Conseil européen.
S’il s’agit là d’une bonne nouvelle pour les Européens qui bénéficieront d’un accès plus rapide aux nouveaux traitements, il n’en va pas de même pour les Suisses. Avec des délais plus courts, l’UE renforce son attractivité auprès des fabricants pharmaceutiques. Si elle vient à se concrétiser, cette mesure rendra la procédure suisse plus longue en comparaison internationale.
Un processus parallèle plutôt que séquentiel
Conscient de la nécessité de coopérer pour délivrer plus rapidement ses autorisations, Swissmedic participe depuis 2020 au projet Orbis, une initiative qui renforce la collaboration internationale entre les agences nationales de huit pays (dont entre autres les Etats-Unis, l’Australie, le Canada, le Royaume-Uni) en permettant l’examen parallèle des traitements anticancéreux prometteurs avec la FDA. Swissmedic est également membre de l’Access Consortium, une initiative qui favorise le partage des connaissances et la répartition du travail avec les autorités de réglementation de l’Australie, du Canada, de Singapour et du Royaume-Uni.
Prendre part à ces projets a permis à Swissmedic de réduire le temps nécessaire pour l’octroi des autorisations de mise sur le marché des médicaments concernés. Toutefois, l’autorisation de Swissmedic n’est qu’une première étape. Du point de vue des fabricants pharmaceutiques, c’est la durée totale, soit de l’autorisation jusqu’à la prise en charge par les caisses maladie, qui est déterminante. En Suisse, cette procédure est séquentielle : les évaluations et les négociations de prix des nouveaux médicaments par l’OFSP n’interviennent qu’après l’autorisation délivrée par Swissmedic. Cette pratique est notamment regrettable pour les médicaments innovants, car elle prolonge inutilement le processus et les patients ne peuvent pas profiter de traitements alternatifs pendant ce temps. En effet, tant que l’OFSP n’a pas déterminé un prix, le médicament concerné ne peut être pris en charge de façon systématique par la LAMal.
Il serait donc préférable que les entreprises pharmaceutiques et l’OFSP se mettent d’accord le plus tôt possible sur les documents et les études cliniques nécessaires à l’évaluation que réalise l’OFSP. Cela permettrait de mener les évaluations en parallèle plutôt qu’en séquentialité. Idéalement, cette concertation devrait avoir lieu bien avant le dépôt de la demande d’autorisation auprès de Swissmedic. Un essai pilote récent mené par l’OFSP a montré qu’un tel procédé est réalisable et permet en effet un accès plus rapide.
Plus d’innovation, aussi dans le processus
Pour optimiser l’ensemble du processus et réduire les délais de remboursement, Avenir Suisse propose d’imposer la prise en charge des médicaments innovants à un prix provisoire dès leur autorisation de mise sur le marché, une idée que la CSSS-N a, sur le principe, récemment soutenu. Une autre proposition d’Avenir Suisse pour rendre cette procédure plus attractive serait de permettre une fixation des prix des médicaments basée sur leur valeur ajoutée, mesurée de façon objective.
Pour la Suisse, l’accès rapide aux nouveaux médicaments ne va pas de soi. Pour mieux concurrencer les Etats-Unis et l’UE malgré sa petite taille, la Suisse doit poursuivre ses efforts pour réduire les délais d’autorisation et de prises en charge en se démarquant par un système attractif de fixation des prix et d’accès aux médicaments. Si rien ne change, la Suisse risque de passer à côté d’innovations pharmaceutiques et finalement, ce sont les patients qui en feront les frais.
Pour en savoir plus sur ce sujet, consultez notre nouvelle publication «Un juste prix pour les nouveaux médicaments – Assurer un accès rapide aux innovations chères et garantir leur financement».